ラボとフィールドを行き来し、ウイルスの「本当の姿」に迫る

人間をもっとも多く殺している危険な生物は何か――。マイクロソフト社の創業者であるビル・ゲイツ氏が、そんなセンセーショナルなタイトルをつけて2014年に自身のブログで公開した記事は、インターネット上で大きく話題になった。
それによれば、人間にとってもっとも危険な生物は「蚊」だ。年間72万5,000に及ぶ人が命を落としている。だが、蚊そのものに人間を殺傷する能力があるわけではない。蚊によって多くの病原体が媒介され、感染症によって多くの人が犠牲になっているのだ。
そのうちもっとも深刻なのは、マラリア原虫という単細胞生物によって引き起こされるマラリアだが、蚊が媒介するウイルスもときに人の命を奪う。北海道大学人獣共通感染症リサーチセンターの澤教授の研究グループは、蚊媒介性ウイルスの研究に力を入れて取り組んでいる。
ウイルスという曖昧な存在

蚊をすりつぶし、ウイルスの遺伝子が含まれているかを調べる実験の様子。ザンビアから来日している研究生・留学生に実験手順を伝えているところ。
ウイルスは、生物と無生物の中間的な性質を持つ曖昧な存在だ。生物の細胞と同じように、膜や殻で自身を外界から隔て、その中に、生物と同様にDNA(デオキシリボ核酸)もしくはRNA(リボ核酸)を遺伝子として持っている。
だが、ウイルスは単体で「生き延びる」ことができない。生物の細胞に寄生し、細胞のメカニズムを乗っ取ることで「生きている」。細胞に自身の遺伝子を複製させ、タンパク質をつくらせる。それにより子孫ウイルスが生まれ、増殖する。ウイルスが感染する生物のことを「宿主」と呼ぶ。
このように、ウイルスは細胞内においてのみ「生物らしい」動的な振る舞いを見せる。単体で生きられないウイルスは、厳密には「生物」の定義から外れている。

蚊に外来性の物質を注入するインジェクション装置。グローブボックス(中央の箱)の中に蚊を入れて、接眼レンズ周辺の穴も塞ぎ、箱の手前の2つの穴からビニール手袋をつけた手を入れて操作する。ボックス自体が蚊帳に包まれ、さらに部屋全体も二重扉になっており、万が一にも蚊が逃げ出すことを防いでいる。(写真は人獣共通感染症リサーチセンター提供)
ひとくちに「ウイルス」と言っても、その実態は多様だ。生物は遺伝子としてDNAを持つが、ウイルスは遺伝子にDNAを持つ「DNAウイルス」と、RNAを持つ「RNAウイルス」に大きく分類される。さらに、ウイルス粒子の形態と構造や、どの宿主に感染してどんな病気を引き起こすかなどの基準によって細かく分類されている。また、宿主に感染しても病気を引き起こさないウイルスが、自然界に多数存続していることも明らかにされている。
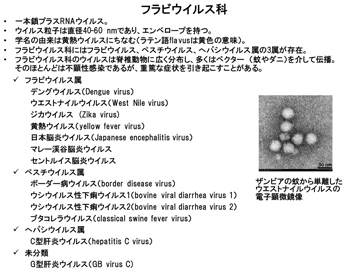
澤教授の研究グループが、研究の一つの柱として取り組むのは、「フラビウイルス属」のウイルスだ。それらの多くは蚊やダニなどの吸血性節足動物によって媒介され、脊椎動物に感染する。こうした特性を持つウイルスを、「節足動物媒介性ウイルス(アルボウイルス)」と呼ぶ。なお、アルボウイルスには、フラビウイルスのほかにもさまざまなウイルスが含まれる。
「アルボウイルスは、蚊やダニなどの体内で増殖し、蚊やダニが吸血する際、脊椎動物に感染します。多くは複数の動物種に感染可能で、ヒトや動物に病気を引き起こすものもあります。自然界の野生動物に寄生し、被害を及ぼさずに存続してきた微生物が、ときに家畜や家禽、ヒトに侵入・伝播して引き起こす悪性の感染症を『人獣共通感染症』といいます。アルボウイルス感染症以外にも、インフルエンザや狂犬病、エボラウイルス感染症などもウイルス性の人獣共通感染症です」
ウイルスはどのようにして神経障害を引き起こすか
フラビウイルス属のウイルスによって引き起こされる感染症を、総称して「フラビウイルス感染症」という。その多くが人獣共通感染症である。フラビウイルス属に分類されるウエストナイルウイルスは、アフリカ、ヨーロッパ、北米、中東から中央および西アジアにかけて広く感染が確認されている。
「ウエストナイルウイルスの名前は、ウイルスが分離された地域に由来しています。1937年、アフリカのウガンダのウエストナイル地方で発熱した女性から、本ウイルスが分離されました。このウイルスは、主に鳥と蚊の間で感染が維持され、蚊を介してヒトやウマに感染します。ヒトが本ウイルスに感染すると、その2割程度が発熱や頭痛などを症状とする『ウエストナイル熱』を発症し、通例は1週間ほどで回復します。しかし稀に、ウイルスが中枢神経系に感染し、致死性の『ウエストナイル脳脊髄炎』が起きます。2018年現在、ヒトに対して有効な治療法はなく、対症療法で症状を緩和することしかできません」
ウエストナイルウイルスの感染が、どのようにして病気を引き起こすのか。病態解明は、澤教授の研究グループの研究テーマのひとつだ。研究の結果、ウエストナイルウイルスが感染した神経細胞に、タンパク質が異常な形で蓄積していることを明らかにした。
細胞内のタンパク質は、さまざまな理由で変性を受ける。変性したタンパク質は本来の機能を失い、本来であれば細胞内から除去される。その除去メカニズムのひとつに、「ユビキチン」と呼ばれるタンパク質が関わっていることが知られる。変性タンパク質にユビキチンが結合し(ユビキチン化)、除去すべきタンパク質であることを知らせる役割を果たすのだ。だが、ウエストナイルウイルスが感染した神経細胞は、ユビキチン化された変性タンパク質が、除去されないまま溜まっていたのだ。
以前から、神経細胞死を伴う神経変性疾患においても、変性タンパク質が蓄積することが知られていた。ウエストナイルウイルスによる神経障害の場合も、神経細胞内のタンパク質がウイルス感染の影響で変性し、除去されずに細胞内に蓄積している。それが神経細胞障害に関与していることが明らかになった。現在も、北大獣医学研究院 公衆衛生学教室と共同で研究を進めている。
澤教授のグループはさらに、ウエストナイルウイルスがどのようにして、細胞から細胞へ感染を広げていくかについても調査を進めた。その結果、細胞内での物質輸送に関わるタンパク質(細胞内輸送因子)「Rab8b」が、ウエストナイルウイルスの細胞からの放出に関与していることを明らかにした。
Rab8bが欠損している細胞では、ウエストナイルウイルスの細胞からの放出が妨げられる。そのことから、Rab8bが、ウエストナイルウイルスの細胞膜への輸送を担っていることを突き止めたのである。この成果は、米国生化学分子生物学会が発行している学術誌『Journal of Biological Chemistry』に、2016年に発表された。
日本も決して対岸の火事ではない
ダニの顕微鏡写真。ダニにも多くの種があり、種によって感染・媒介するウイルスも異なる。澤教授の研究グループは、国内、およびアフリカを含む外国でダニを採集し、フレボウイルスなどの保有状況を調べている。
澤教授のグループは、新興・再興感染症の原因となるウイルス感染症をターゲットにした治療法開発にも取り組んでいる。塩野義製薬との共同研究だ。
2014年に東京の代々木公園を中心に広まったデング熱の流行は、メディアで大きく報道された。デング熱の本来の流行地域は、熱帯・亜熱帯のアジア・アフリカ・中南米である。日本では、太平洋戦争のさなかの1940年代前半に東南アジアの戦地から持ち帰られ、西日本で大きな流行を起こして以来、約70年ぶりの流行だった。
「デング熱の流行は、ネッタイシマカやヒトスジシマカによって媒介されたデングウイルスが、ヒトからヒトへ伝搬することによって広がります。デングウイルス感染者のうち20~50 %ほどが、発熱を主症状とするデング熱を発症し、感染後一週間程度で回復します。ただ、重症化すると出血症状を呈して死亡するケースもあります。2018年現在、デング熱の予防法も治療法もいまだに確立されていません。100ヶ国を超える流行地域で、あわせて4億人近いヒトが感染しているとの報告があります」
ウエストナイル熱やデング熱などのように、近年になって注目を集めるようになった感染症を「新興・再興感染症」という。人獣共通感染症リサーチセンターは、塩野義製薬とともにセンター内に「シオノギ 抗ウイルス薬研究部門」を設置し(2018年)、新興・再興感染症の病原体ウイルスの薬剤開発に向けた研究を進めている。塩野義製薬が保有する低分子化合物が、これらのウイルスに対して効果があるか、精力的にスクリーニングしている。

北海道で採集したダニから分離した新規フレボウイルスが、哺乳類由来の細胞に感染するかを確認する実験。顕微鏡でウイルスの感染状況を確認する。
国内で発生・流行が確認されているフラビウイルス感染症は、デング熱だけではない。日本脳炎とダニ媒介性脳炎も、たびたび感染例の報告や、ウイルスを保有する蚊やダニが発見されており、決して対岸の火事ではない。また、ジカウイルスに海外で感染し、国内で発症した輸入症例も確認されている。
黄熱は、国内での発症例は報告されていないが、日本人には馴染み深い感染症のひとつだろう。医師であり細菌学者の野口英世博士(1876-1928)が、研究中に黄熱ウイルスの感染により亡くなったことはよく知られている。なお、2016年にはアフリカのアンゴラとコンゴ民主共和国で、2018年にはブラジルで、黄熱の流行(アウトブレーク)が報告された。
ダニはフラビウイルス属以外にもさまざまなウイルスを媒介する。日本でも、フレボウイルス属のウイルスが引き起こす「重症熱性血小板減少症候群(SFTS)」が重大な脅威となっている。2013年1月に報告されて以来、2018年7月までに368例のSFTS症例が報告され、内63名が死亡しているのだ。澤教授の研究グループは、国内外で蚊やダニを採集し、フラビウイルスやフレボウイルスを含むアルボウイルスの保有状況を調査している。
フィールドで見つかった新たなウイルス
人獣共通感染症リサーチセンターの活動はラボでの研究にとどまらない。国内外のフィールドに出向き、さまざまな人獣共通感染症の疫学調査を行っている。疫学調査とは、病原体の分布域、宿主の病原体保有状況などを調べ、感染症の発生や流行を予測し、発生した感染症の伝搬経路や流行要因などを究明する調査のことだ。
センターの活動として特筆すべきは、アフリカ南部のザンビア共和国を拠点にした疫学調査だ。2007年、ザンビア大学獣医学部にセンターの「ザンビア拠点」を開設し、センター所属の職員が常駐して、継続的に調査を行っている。澤教授の研究グループも年に数回のペースでザンビアに赴き、これまでの渡航回数は50回を超えるという。
「ザンビアでは、政府当局の許可を得てさまざまな野生動物を捕獲し、病原体の保有状況を継続的に調査しています。人獣共通感染症は、野生動物が病原体を運ぶキャリア(運び屋)となるため、根絶が不可能です。人間社会への影響を最小限に抑えるには、自然界における病原体の保有宿主(自然宿主)や宿主域、伝播経路などの生態を明らかにして、病原体の感染を防ぐ必要があります。これを私たちは、『先回り対策』と呼んでいます。当センターでは、ラボでの研究とともに、フィールドでの生態学・疫学調査を踏まえた『先回り対策』の策定に力を入れています」
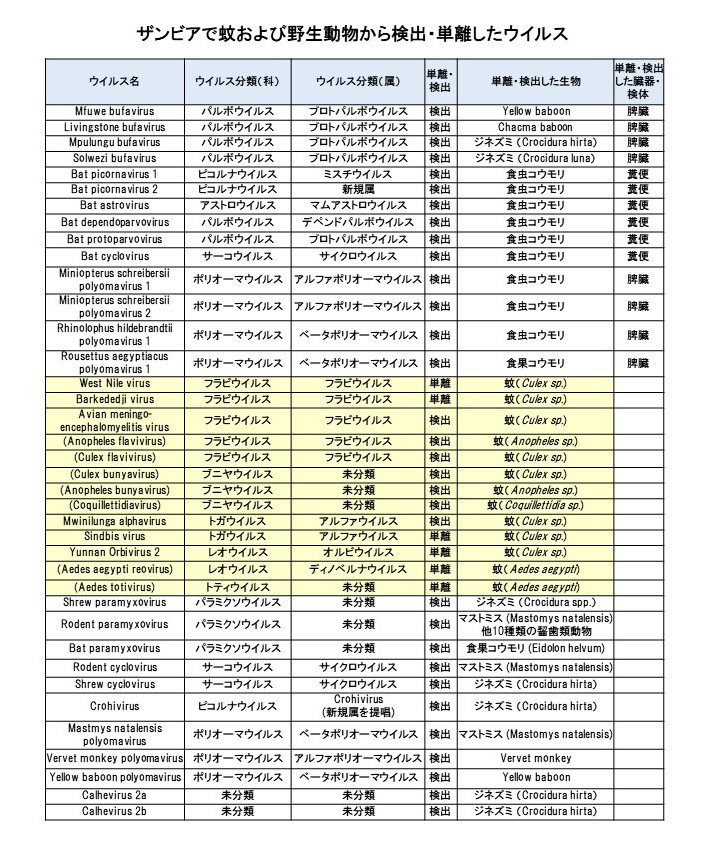
2012年から始めたザンビアでの蚊のアルボウイルス保有状況調査により、多くの既知・新規のウイルスが検出された。2018年には、ザンビアで初めて蚊からウエストナイルウイルスを単離することに成功し、蚊由来の新規のウイルスも検出した。
そのほかにも、ザンビアでの疫学調査では、さまざまな宿主動物から多くの新たなウイルスが見つかっている。地球上には、未知のウイルスが数多く存在していると考えられている。

インドネシアからの研究者と実験結果についてディスカッションする澤教授。
澤教授の研究グループは、ザンビア大学以外にも、さまざまな国の研究機関と国際共同研究に取り組んでいる。インドネシアのボゴール農科大学との共同研究もそのひとつだ。
研究内容は、現地の野生動物がどのような病原体を保有しているかの調査だ。現地の共同研究者が野生動物を集め、研究グループのメンバーが病原体を探索する。これまでに、複数種のコウモリの糞便などから多様なウイルスを検出した。
なお、澤教授の研究グループにはインドネシアからの研究者も所属している。共同研究を通じて、現地の研究者とつながりができたのがきっかけだ。感染症は、国境を越えて広がっていく。それと向き合う研究者も、国境を越えてお互い協力して研究を前に進めている。
ラボとフィールドを行き来して見えてきたこと
今ではウイルスの研究に没頭する澤教授は、かつて医師を志していた。
「もともとは北大の医学部に所属して、臨床医を目指して勉強していました。次第に基礎研究が面白くなり、大学院に進学して長嶋和郎先生(第二病理学講座)の下で勉強させていただきました。博士課程修了後、米国留学を経て再び長嶋先生の下で、ウイルスの細胞内感染動態の研究を始めたのが、ウイルス研究を始めたきっかけです。2005年には、喜田宏教授がセンター長を務める人獣共通感染症リサーチセンターに着任しました。医学部に所属していた際にはラボでの研究がメインでしたが、センターに来て以降、フィールドに出る機会をいただき、研究の幅が大きく広がりました。」
澤教授は、ラボとフィールドを行き来して、どのようなことを感じているのだろうか。
「フィールドに出て実感するのは、ウイルスは地球上に存続しているというシンプルな事実です。実験室でもウイルスを培養することはできますが、培養中に実験室環境に適応した株に変異していきます。自然界に存続するウイルスそのままではありません。フィールドでの活動で、そのことに気づきました」
それにより、考え方も大きく変わってきたと澤教授は言う。
「私は病気を引き起こす病原体として、ウイルスの研究を始めました。ところが、自然界に存在するウイルスは、病原性を有するものだけではありません。というよりもむしろ、病気を引き起こすウイルスの方が少ないのが実態です。ウイルスは、宿主がいなければ生きていくことができません。宿主を殺してしまうような病原性が高いウイルスは、ウイルスの進化における特別な例なのではないか。かつては、細菌といえば病原体と考えられていましたが、今では宿主と共生する『共生細菌』の存在が広く知られるようになっています。大多数のウイルスは、自然のなかで生態系における何らかの役割を持って存在している。今ではそう考えるようになりました。」

研究について熱を込めて語る澤教授。
澤教授の研究グループは、2016年から新たな取り組みに参加している。「病原微生物としてのウイルス」という見方を超え、自然界におけるウイルスの存在意義や、生物の生命活動や生態系に及ぼす影響などの解明を目指すチャレンジングな研究だ。研究プロジェクト名は「ネオウイルス学:生命源流から超個体、そしてエコ・スフィアーへ」。エボラウイルスやインフルエンザウイルスの世界的研究者である東京大学医科学研究所の河岡義裕教授が領域代表を務め、研究を推進している。
そのなかで澤教授のグループは、ウイルスと宿主の「共進化」に焦点を当てた研究に取り組んでいる。吸血性節足動物と、それらが媒介するウイルスは、いかにして「共進化」してきたのか。これまでの研究の蓄積を活かし、「ウイルスとは何か」を捉え直す研究に精力的に取り組んでいる。
もうひとつ、澤教授がフィールドの現場から得た鮮烈な印象があるという。
「アフリカに行くと、病気で困っている患者さんを間近に見る機会もあります。ザンビアの平均寿命は40歳代です。その理由は、幼い子が感染症で命を落とすからです。アフリカでも首都のような都市部ではインフラが比較的整っていますが、都市から少し離れると、井戸水や川の水を飲料水として使っています。衛生状況は決して良好とは言えず、それが感染症の温床になっています。日々、感染症の危険にさらされている方たちのために、なんとかして感染症の脅威を少しでも減らしたい。それが日々の研究の原動力になっています。」
人命を救いたい――。かつて医師を目指した澤教授の思いは、今もたしかに息づいている。

分子病態・診断部門 教授

北海道大学人獣共通感染症リサーチセンター
http://www.czc.hokudai.ac.jp/
「人獣共通感染症の克服」を目指し、人獣共通感染症に特化した研究・教育を推進するとともに、世界中から診断・研究材料を受け付け、これらに対応する中核拠点である。人獣共通感染症の予防・制圧方法を統括的に研究する組織は世界にも数少なく、世界を先導すべく2005年に設置された。
ラボでの研究やフィールドでの調査に加え、国境を越えて広がる感染症のリスクに備えるため、WHO(世界保健機関)やOIE(世界動物衛生機関)などの国際組織との連携にも力を入れて取り組んでいる。2011年11月25日には、WHOの人獣共通感染症対策研究協力センターに指定されている。
【取材・文:萱原正嗣 撮影:兼成純一】